国立大学法人筑波大学
大学共同利用機関法人高エネルギー加速器研究機構
概要
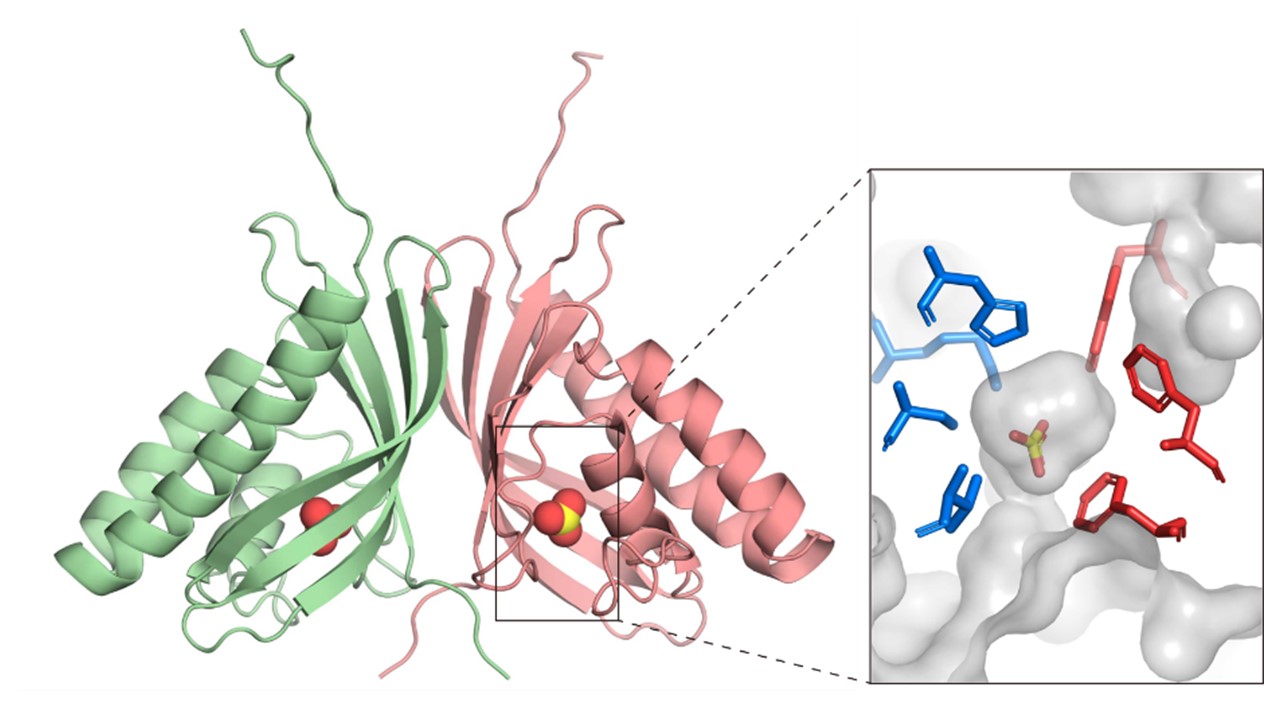
炭酸脱水酵素(Carbonic anhydrase; CA)は、バクテリアから真核生物まで様々な生物に存在し、二酸化炭素と重炭酸イオンを相互変換する反応の触媒として作用します。この反応は、呼吸や光合成、細胞のpH恒常性などに関わるもので、現在までに8つの異なる種類のCAが報告されています。これらは、タンパク質の配列や構造は異なるものの、全て、活性中心に亜鉛などの金属補因子(金属イオン)を含む金属酵素として知られていました。
本研究では、バクテリアや真核藻類に広く保存されている機能未知タンパク質COG4337が、金属イオンを持たない新規のCAであることを、生化学的解析とX線結晶構造解析により発見しました。これまでCAは、活性中心の金属イオンが水分子の活性化を行うと考えられてきましたが、COG4337タンパク質は、親水性と疎水性のアミノ酸で構成される小さな穴を持ち、その内部で水分子と二酸化炭素を反応させて重炭酸イオンの合成を行います。すなわち、従来知られているものとは異なるメカニズムを持ちます。金属イオンを必要としないCOG4337タンパク質は、陸から離れた海洋など金属の乏しい環境でも機能することができるため、そのような環境に生息する生物において進化したと推測されます。本研究成果は、「炭酸脱水酵素=金属酵素」という固定概念を覆し、CAの新たな多様性を示すものです。
本成果は、5⽉18⽇に国際学術誌BMC Biologyに掲載されました。
詳しくは プレスリリース をご参照ください。
