学校法人同志社 同志社大学
大学共同利用機関法人高エネルギー加速器研究機構
国立研究開発法人日本医療研究開発機構
概要
血清型O157に代表される腸管出血性大腸菌による感染症は、毎年世界中で多くの感染者・死者を発生させています。また、抗生物質の使用は症状を増悪させる可能性も示唆され、WHOの治療指針においても検討課題とされており、有効な治療薬がない状況です。
志賀毒素(Shiga toxin; Stx)は腸管出血性大腸菌が産生する主要な病原因子であり、その毒性を阻害する分子は有望な治療薬として期待できます。
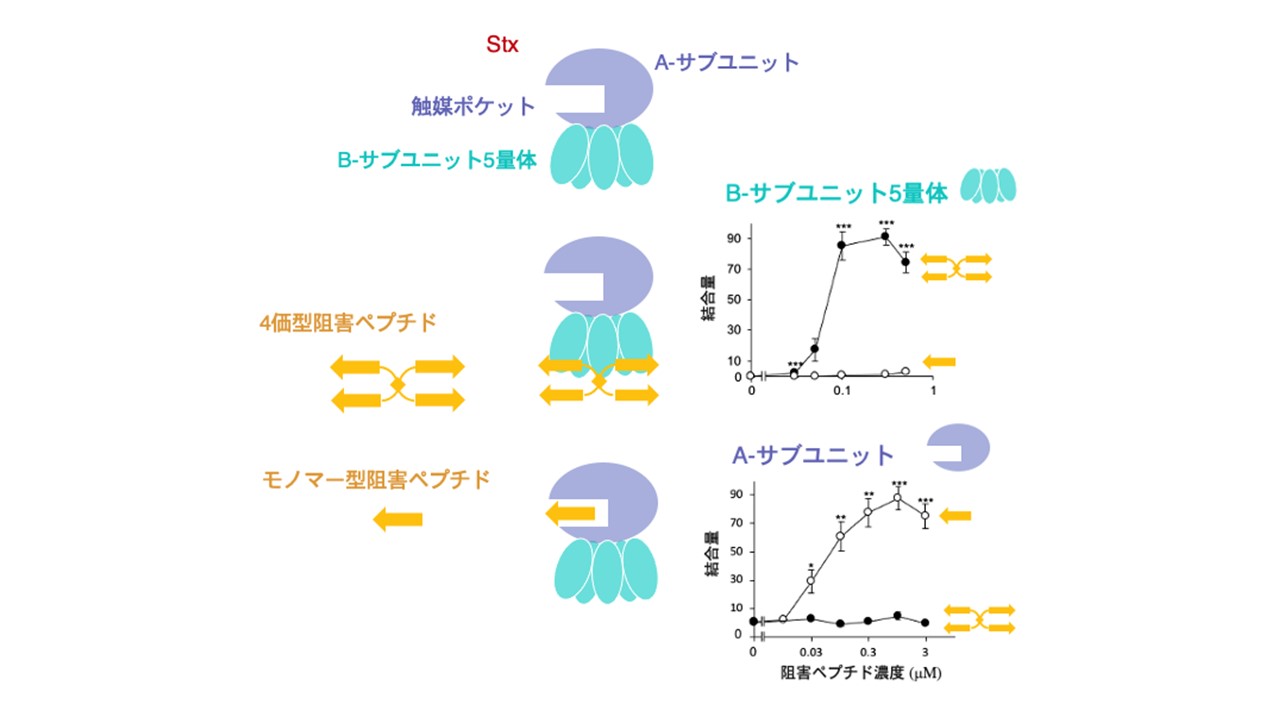
Stxは、標的となる細胞のタンパク質合成を阻害するA-サブユニットと、標的細胞上に存在する受容体を認識しA-サブユニットを細胞内に届ける働きを持つB-サブユニット5量体から構成されています。
同志社大学生命医科学部の高橋美帆助教、高エネルギー加速器研究機構 物質構造科学研究所の千田美紀特任助教、千田俊哉教授、および同志社大学大学院生命医科学研究科の西川喜代孝教授らの研究グループは、Stxの機能が異なる2つのサブユニットに共通して結合し、その働きを阻害するペプチド分子を同定しました。同定したペプチドについて、X線結晶構造解析を行ったところ、A-サブユニットとの結合様式の詳細が解明され、本ペプチドのカルボキシル末端の5アミノ酸からなる領域がA-サブユニットの触媒ポケットをほぼ塞ぐように結合していることを見出しました。
これまでA-サブユニットの機能を阻害することが確認されたペプチドは同定されておらず、本成果は、腸管出血性大腸菌感染症に対する新たな治療薬開発に貢献すると考えられます。
本研究成果は、日本時間2021年5月10日に英国科学誌Communications Biology(オンライン版)に掲載されました。
本研究成果のポイント
◆O157などの腸管出血性大腸菌が産生する志賀毒素について、毒素タンパクを構成している機能的に全く異なる2つのサブユニットを共通して阻害するペプチドを同定しました。
◆志賀毒素の毒素本体であるA-サブユニットと同定したペプチドとの結合様式の詳細を、X線結晶構造解析により解明することに成功しました。
◆本成果は、いまだに有効な治療薬のない腸管出血性大腸菌感染症に対する新たな治療薬開発に貢献すると考えられます。
詳しくは プレスリリース をご参照ください。
